متاآنالیز (Meta-analysis) یک روش آماری است که چندین مطالعه را ترکیب میکند و نتایج آنها را یکپارچه میکند. متاآنالیز حجم نمونه را افزایش میدهد و بهنوبه خود، قدرت مطالعه اثرات موردبررسی را با ترکیب مطالعات اولیه و ارائه تخمین دقیق از اثرات افزایش میدهد؛ بنابراین، متاآنالیز تخمین دقیقتری از اثر ارائه میدهد. متاآنالیز مبتنی بر قوانین ریاضی و آماری است؛ بنابراین نسبت به روشهای دیگر مانند ریویو روایی (Narrative)عینیتر است و کمتر تحت تأثیر نظرات شخصی نویسنده قرار میگیرد؛ بنابراین، استفاده از متاآنالیز بهطور ویژهای محبوب میشود. متاآنالیز زمانی میتواند ابزار قدرتمندی باشد که بهخوبی طراحی و اجرا شود. بااینحال، ممکن است همیشه بهترین ابزار نباشد و بحثبرانگیز است. متاآنالیز دارای چندین محدودیت است که میتواند منجر به نتایج گمراهکننده شود. علاوه بر این، ممکن است در برخی موارد مناسب نباشد. اگرچه متاآنالیز به دلیل محدودیتهایی که دارد موردانتقاد قرارگرفته است، اما راهحلهایی برای چنین مشکلاتی وجود دارد.[1]
دادههای ترکیبشده از متاآنالیز ها معمولاً سودمندتر از نتایج ریویوهای روایی هستند. در یک متاآنالیز، تصمیمات شفاف هستند و تجزیهوتحلیل آماری معیاری عینی از شواهد کمی یکپارچه را به دست میدهد. سوگیریهای ریویوهای روایی را میتوان با انجام یک متاآنالیز محدود کرد یا بر آن غلبه کرد. رویکرد سیستماتیک و شفافیت در متاآنالیز به حل تعارضات و عدم قطعیتهای بین مطالعات کمک میکند، درحالیکه منجر به نتیجهگیری قابلتوجهی میشود. هدف متاآنالیز گردآوری حجم زیادی از اطلاعات در مورد یک موضوع معین است.
متاآنالیز روشی است که بهطور گسترده در تمام زمینههای تحقیقات زیست پزشکی برای تفسیر کلی مطالعات متعدد و متنوع و گاه متناقض استفاده میشود. همچنین توسط جوامع آموخته در یکرشته پزشکی برای ایجاد توصیههایی برای مراقبت و درمان بیماران بر اساس شواهد استفاده میشود. اولین متاآنالیزها به دهه 1970 برمیگردد و تعداد آنها از آن زمان به بعد افزایشیافته است.[2]
چرا متاآنالیز انجام دهیم؟
متاآنالیز تلفیق و ترکیبی از مطالعات مختلفی است که در مورد یک موضوع خاص وجود دارد و امکان استحکام و شفافسازی نتایج حاصل از مطالعات مختلف را فراهم میکند. بهمحض انجام چندین مطالعه که پاسخگویی به یک سؤال را بهعنوان یک هدف اولیه یا ثانویه انجام دادهاند، متاآنالیز امکانپذیر میشود. اینیک روش ضروری برای سنتز مطالعات است و این امکان را فراهم میکند تا پاسخ دقیق و جهانی مطابق با تمام دانش روز ارائه شود. دامنه فقط محدود به مطالعات موجود است. اولین حوزه کاربرد، ارزیابی اثربخشی و عوارض جانبی درمانهای دارویی است. متاآنالیز همچنین میتواند در زمینههای دیگر مانند اپیدمیولوژی، مدیریت درمانی، مراقبت بهطورکلی، غربالگری یا تشخیص بسیار مفید باشد.
در مورد مطالعات روی یک دارو، متاآنالیز میتواند بهاندازه گیری اثربخشی و تحمل این دارو کمک کند. درواقع، گردآوری مطالعات بالینی مختلف که هرکدام شامل تعداد کمی از بیماران است، افزایش این تعداد را ممکن میسازد تا مشاهدات از نظر آماری معنیدار باشند. پسازآن، متاآنالیز میتواند تأثیر یک درمان را برجسته کند، زمانی که کار آزمایی های کوچک لزوماً اجازه نمیدهد که نتیجهگیری شود. انجام یک کارآزمایی بالینی در مقیاس بزرگ در عمل بسیار دشوار است. متاآنالیز بر این مشکل غلبه میکند. همچنین میتواند به تصمیمگیری، زمانی که نتایج متناقض هستند، کمک کند. سمت ترکیبی آن نیز امکان جمعآوری دادهها را برای دستیابی به پاسخ دقیق به یک سؤال فراهم میکند. این امر بهویژه در زمینههای تحقیقاتی که دادهها در آنها جمع میشود مفید است.[3]
یک متاآنالیز چگونه انجام میشود؟
در پزشکی برای انجام یک متاآنالیز، محقق موضوع موردنظر را تعریف میکند که میتواند درمانی باشد که باید آزمایش شود، یک نوع بیمار ارزیابی میشود، دادههای اپیدمیولوژیک، مفاهیم مراقبت و غیره.
مرحله دوم، تعریف معیارهای گنجاندن در متاآنالیز موردنظر است. سپس محقق به دنبال آزمایشها و مطالعات مختلف، منتشرشده یا غیر منتشرشده در ادبیات پزشکی میگردد. این مطالب میتواند مقالات، پوسترها، ارتباطات کنفرانسهای پزشکی، پایاننامههای دانشجویی، کارآزمایی های بالینی و غیره باشد. در صورتی انتخاب میشوند که معیارهای ورود در متاآنالیز را داشته باشند. ایده این است که تا حد امکان بسیاری از مطالعات را در متاآنالیز گرد هم بیاوریم تا بیشترین ارزش و قدرت ممکن را به آن بدهیم.
سپس از تکنیکهای تحلیل آماری استفاده میشود. تجزیهوتحلیل بر اساس زیر گروهها (جنس، سن، سابقه پزشکی، نوع بیماری و غیره) قابل انجام است. بهطورکلی، چندین محقق بهمنظور دادن وزن بیشتر به تجزیهوتحلیل، خوانش های خود را ارجاع متقابل میکنند.[1]
مقایسه متاآنالیز و ریویو روایی
دادههای آنالیز شده از متاآنالیز معمولاً سودمندتر از نتایج ریویوهای روایی هستند، زیرا دومی دارای معایب متعددی است که میتوان با متاآنالیز بر آنها غلبه کرد. ریویوهای روایی بر اساس انتخاب ذهنی از انتشارات است؛ بنابراین، انتخاب مطالعه میتواند دلخواه باشد. در یک ریویو روایی، فقدان یک استراتژی جستجوی خاص، خطر شکست در شناسایی مطالعات مرتبط در یک موضوع خاص را افزایش میدهد. علاوه بر این، مطالعات انتخابشده ممکن است بهطور انتقادی ارزیابی نشوند، قدرت شواهد ممکن است وزن نداشته باشند و ممکن است هیچ تحلیل کمی روی دادهها انجام نشده باشد. در ریویوهای روایی، ممکن است مقایسه اثرات مطالعاتی که از معیارهای متفاوتی برای اندازهگیری یک نتیجه مشابه استفاده میکنند، دشوار باشد. نویسنده در یک ریویو روایی بهطور کیفی با جمعبندی یافتههای مطالعات دیگر و نتیجهگیری به یک سؤال میپردازد؛ بنابراین، ریویوهای روایی مستعد سوگیری و خطا هستند، زیرا بازبینان مختلف ممکن است نتایج متفاوتی از شواهد یکسان بگیرند؛ بنابراین، ریویوهای روایی باید نظراتی با سطح شواهد پایین در نظر گرفته شوند. ازاینرو، ترکیبهای تحقیقاتی سیستماتیک شفافتر و تکرارپذیرتر ممکن است در صورت وجود اختلافنظر بین نتایج مطالعات، هرگونه عدم قطعیت را حل کند. متاآنالیز با بهکارگیری یک رویکرد روششناختی سوگیری را به حداقل میرساند. در متاآنالیز، تصمیمات شفاف هستند و تجزیهوتحلیل آماری به یک اندازهگیری عینی از شواهد کمی یکپارچه منجر میشود که سپس میتواند تکرار و تأیید شود. علاوه بر این، متاآنالیز نتایج مطالعات اولیه را به یک متریک مشترک بهعنوان اندازه اثر تبدیل میکند، بنابراین معیارهای متفاوت از مطالعات اولیه را میتوان با یکدیگر مقایسه کرد و نتیجهگیریهایی را به دست آورد که معنادارتر هستند. با انجام یک متاآنالیز، میتوان سوگیریهای ریویوهای روایتی را محدود یا بر آن غلبه کرد؛ بنابراین، متاآنالیز برای ارائه شواهد با بالاترین سطح دقت در نظر گرفته میشود.[4]
نقاط قوت متاآنالیز
متاآنالیز میتواند نتایج حاصل از مطالعات فردی را خلاصه و کمی کند. علاوه بر این، میتواند ناهمگونی بین نتایج مطالعات مختلف را روشن کند و تفاوتها را در نتایج تحلیل کند. یک مطالعه فردی ممکن است شامل تعداد بسیار کمی از افراد در یک زیرگروه خاص باشد. بااینحال، دادههای متا تحلیلی از چندین مطالعه فردی ممکن است تصویر واضحتری از زیرگروه ارائه دهد. متاآنالیز با افزایش حجم نمونه، قدرت آماری را افزایش میدهد و میتواند با ترکیب دادههای مطالعات متعدد، اثرات کوچک اما ازنظر بالینی مهم را تعیین کند.
دقت یافتههای یک مطالعه تا حد زیادی به تعداد افراد بستگی دارد. ترکیب آماری دادههای مطالعات فردی میتواند تخمین دقیقتری از اثرات اساسی نسبت به یک مطالعه ارائه دهد؛ بنابراین، متاآنالیز بر محدودیت حجم نمونه کوچک مطالعات فردی غلبه میکند، اثرات موردعلاقه را تشخیص میدهد و خطر نتایج منفی کاذب را کاهش میدهد. علاوه بر این، متاآنالیز میتواند اختلافات ناشی از مطالعات با نتایج متناقض را حل کند. علاوه بر این، ترکیب مطالعات اولیه با اندازه نمونه و جمعیت بیماران مختلف میتواند تعمیمپذیری نتایج مطالعات فردی را افزایش دهد. این اجازه میدهد تا نتایج متاآنالیز به جمعیت وسیعتری تعمیم داده شود. بررسی مناسب ناهمگونی بین مطالعات فردی امکان آزمایش فرضیههای جدیدی را فراهم میکند که در مطالعات قبلی ارائه نشدهاند. همانطور که متاآنالیز دانش موجود را خلاصه میکند، ممکن است به شناسایی حوزههایی که فاقد شواهد کافی هستند کمک کند و درنتیجه سؤالات پژوهشی جدیدی ایجاد کند. متاآنالیز بر مشکلات و سوگیریهای ریویو روایت سنتی از طریق فرآیندی شفافتر و ذهنیتر که شامل رویکرد روششناختی سیستماتیک است، غلبه میکند.[5]
نقاط ضعف متاآنالیز
خلاصه کردن مقادیر زیادی از اطلاعات مختلف با استفاده از یک عدد واحد، جنبه بحثبرانگیز متاآنالیز است، زیرا این واقعیت را نادیده میگیرد که اثرات درمان ممکن است از مطالعهای به مطالعه دیگر متفاوت باشد. بااینحال، یک متاآنالیز نتایج را باوجود تفاوت در تحقیقات اولیه تعمیم میدهد و بهسادگی یک اثر خلاصه را گزارش نمیکند. اگر ناهمگونی قابلتوجهی وجود داشته باشد، آنگاه تمرکز باید از اثر خلاصه به خود ناهمگنی تغییر کند. متاآنالیز ابزارهای مختلفی را برای ارزیابی الگوی ناهمگونی و احتمالاً توضیح آن فراهم میکند.[6]
• مخلوط کردن سیب و پرتقال
دو انتقاد اصلی به متاآنالیز این است که انواع مختلف مطالعات ("مخلوط کردن سیب و پرتقال ") را ترکیب میکند و این که اثر خلاصه ممکن است تفاوتهای مهم بین مطالعات را نادیده بگیرد. اگر مطالعات بیشازحد ناهمگن هستند و قابلمقایسه نیستند، باید از متاآنالیز اجتناب شود، زیرا نتایج متاآنالیز ممکن است بیمعنی باشد و اثرات واقعی ممکن است مبهم باشد. بااینحال، متاآنالیز ها، به دلیل ماهیت خود، به سؤالات گستردهتری نسبت به مطالعات فردی میپردازند؛ بنابراین، میتوان گفت که یک متاآنالیز مشابه پرسیدن سؤالی در مورد میوهها است که هم سیب و هم پرتقال میتوانند اطلاعات ارزشمندی را برای آن به اشتراک بگذارند.[7]
• ورودی اشتباه خروجی اشتباه
عبارت «ورودی اشتباه خروجی اشتباه» به این معنی است که اگر یک متاآنالیز شامل مطالعات باکیفیت پایین باشد، نتایج آن مغرضانه و نادرست خواهد بود. متاآنالیز شامل مجموعهای از معیارها برای تعیین اینکه کدام مطالعه باید تجزیهوتحلیل شود. ازاینرو، فرا تحلیل باید بر اساس معیارهای سختگیرانه تری در رابطه با کیفیت مطالعاتی که باید گنجانده شود، باشد. هنگامیکه مطالعات موجود ناقص هستند، یک متاآنالیز ممکن است از تحلیلهای حساسیت برای شناسایی تأثیر سوگیریهای مطالعه استفاده کند.[7]
• ناهمگونی
در متاآنالیز، ناهمگونی به میزان عدم تشابه در نتایج مطالعات فردی اشاره دارد. فرض اصلی برای انجام متاآنالیز این است که مطالعات ازنظر جمعیت، مداخلات، کنترلها و پیامدها همگن هستند. ارزیابی ناهمگونی بین مطالعات اولیه گام مهمی در انجام یک متاآنالیز است. اگر ناهمگونی قابلتوجهی وجود داشته باشد، تمرکز تحلیل باید بر کاوش و درک منابع تنوع باشد. متاآنالیز وجود ناهمگونی را در میان مطالعات اولیه بررسی میکند و واریانس نتایج آنها را تحلیل میکند. برای کشف منابع ناهمگونی از تحلیلهای زیرگروهی و متارگرسیون استفاده میشود. بااینحال، اگر مقدار قابلتوجهی ناهمگونی وجود داشته باشد، ممکن است ادغام دادهها در یک متاآنالیز مناسب نباشد.[8]
• سوگیری مقالات
مطالعاتی که اثرات مثبت را گزارش میکنند معمولاً بیشتر از آنهایی که منتشر نمیکنند منتشر میشوند و مطالعاتی که نتایج قابلتوجهی را گزارش نمیکنند معمولاً منتشرنشده باقی میمانند. ازآنجاییکه متاآنالیز فقط شامل مطالعات منتشرشده است، ممکن است میزان واقعی یک اثر را بیشازحد برآورد کند. این نتیجه "سوگیری انتشار " نامیده میشود. برای کاهش تأثیر سوگیری انتشار بر فرا تحلیل، باید تلاش جدی برای شناسایی همه مطالعات مرتبط انجام شود، زیرا نتیجه فرا تحلیل به مطالعات گنجاندهشده بستگی دارد. اگر مشکوک به وجود سوگیری انتشار باشد، گاهی اوقات میتوان آن را با استفاده از نمودارهای قیف و آمارهای مربوطه، مانند آزمون رگرسیون خطی ایگر برای اندازهگیری عدم تقارن نمودار قیف یا روش «تریم و پر کردن» برای تنظیم تخمینهای خلاصه سوگیری مشاهدهشده تشخیص داد.[7]
• همه متغیرها قابلمقایسه نیستند
برخی از متغیرها معیار قابلمقایسهای برای متاآنالیز ندارند؛ بنابراین، گاهی اوقات ممکن است نیاز به ساخت متغیرهای جدیدی باشد که مفاهیم قابلمقایسهای را ارائه دهند یا تحلیلها را به عناصر مشترک محدود کنند.
• متاآنالیز میتواند با آزمایشهای تصادفی مخالف باشد
دلیل اصلی اختلاف در متاآنالیز این است که بر اساس مطالعات ناهمگن و اغلب کوچک است. افراد در مطالعات فردی ممکن است با توجه به معیارهای تشخیصی، بیماریهای همراه، شدت بیماری و منطقه جغرافیایی متفاوت باشند. در مقابل، در آزمایشهای تصادفی و کنترلشده بزرگ، جمعیت هدف محدودتر است. بااینحال، متاآنالیز که بهدرستی انجام شود ممکن است اطلاعات ارزشمند تکمیلی را ارائه دهد.[4]
• متاآنالیز نمیتواند بر ذهنیت غلبه کند
متاآنالیز بهجای عینیت، بر ذهنیت مشترک متکی است. هنگام تصمیمگیری در مورد اینکه چگونه مطالعات مشابه باید قبل از ترکیب آنها مناسب باشد، اغلب مقدار مشخصی ذهنیت وجود دارد. هر شکلی از تحلیل، ازجمله ریویوهای روایی، نیاز به تصمیمات ذهنی خاصی دارد. بااینحال، چنین تصمیماتی همیشه بهصراحت در یک متاآنالیز بیان میشود.
• متاآنالیز فقط به اثرات اصلی میپردازد
متاآنالیز به اثرات اصلی میپردازد و نتایج آن را میتوان به جامعه هدف تعمیم داد. بااینحال، اثرات متقابل ممکن است با تحلیل تعدیلکننده نیز بررسی شود.
فرآیند پنج مرحلهای
در مورد بهترین روش برای متاآنالیز بحث وجود دارد، بااینحال پنج مرحله متداول در ادامه بیانشده است.
مرحله 1: سؤال تحقیق
یک سؤال تحقیق بالینی شناساییشده و یک فرضیه پیشنهاد میشود. اهمیت احتمالی بالینی توضیح دادهشده و طرح مطالعه و طرح تحلیلی توجیه میشود.
مرحله 2: بررسی سیستماتیک
یک مرور سیستماتیک (SR) بهطور خاص برای رسیدگی به سؤال تحقیق طراحیشده و برای شناسایی همه مطالعاتی که هم مرتبط و هم باکیفیت کافی خوب در نظر گرفته میشوند، انجام میشود تا گنجاندن آن را تضمین کند. اغلب، تنها مطالعات منتشرشده در مجلات معتبر شناسایی میشوند، اما شناسایی دادههای «منتشرنشده» برای جلوگیری از «سوگیری انتشار» یا حذف مطالعات با یافتههای منفی مهم است. برای شواهد با بالاترین کیفیت سایر انواع مطالعات "تجربی " و "نیمه تجربی " درصورتیکه معیارهای ورود/خروج تعریفشده را برآورده کنند، ممکن است شامل شوند.
مرحله 3: استخراج دادهها
پس از انتخاب مطالعات برای گنجاندن در متاآنالیز، دادهها یا نتایج خلاصه از هر مطالعه استخراج میشوند. علاوه بر این، اندازه نمونه و اندازهگیری تنوع دادهها برای هر دو گروه مداخله و کنترل موردنیاز است. بسته به مطالعه و سؤال تحقیق، معیارهای نتیجه میتواند شامل معیارهای عددی یا معیارهای طبقهبندی باشد. بهعنوانمثال، تفاوت در نمرات یک پرسشنامه یا تفاوت در سطح اندازهگیری مانند فشارخون بهعنوان یک میانگین عددی گزارش میشود. بااینحال، تفاوت در احتمال قرار گرفتن در یک دسته در مقابل دسته دیگر (بهعنوانمثال، زایمان طبیعی در مقابل زایمان سزارین) معمولاً ازنظر اقدامات خطر مانند OR یا خطر نسبی (RR) گزارش میشود.
مرحله 4: مطالعات استانداردسازی و وزن دهی
با جمعآوری تمام دادههای لازم، مرحله چهارم محاسبه شاخصهای خلاصه مناسب از هر مطالعه برای تجزیهوتحلیل بیشتر است. این معیارها معمولاً اندازه اثر نامیده میشوند و نشاندهنده تفاوت میانگین نمرات بین گروه مداخله و کنترل است. بهعنوانمثال، تفاوت در تغییر فشارخون بین شرکتکنندگان مطالعه که از داروی X استفاده میکردند در مقایسه با شرکتکنندگانی که از دارونما استفاده میکردند. ازآنجاییکه واحدهای اندازهگیری معمولاً در مطالعات شامل متفاوت است، معمولاً برای ایجاد تخمینهای قابلمقایسه از این اثر، باید «استاندارد» شوند. هنگامیکه معیارهای نتیجه متفاوتی استفاده میشود، مانند زمانی که محققان از آزمونهای مختلف استفاده میکنند، استانداردسازی ضروری است. استانداردسازی با در نظر گرفتن میانگین نمره برای هر مطالعه برای گروه مداخله، کسر میانگین برای گروه کنترل و تقسیم این نتیجه بر معیار متغیر در آن مجموعه داده به دست میآید.
نتایج برخی از مطالعات نیاز به وزن بیشتری نسبت به سایرین دارند. تصور میشود که مطالعات بزرگتر (همانطور که با اندازههای نمونه اندازهگیری میشوند) تخمین اندازه اثر دقیقتری را نسبت به مطالعات کوچکتر ایجاد میکنند. دوم، مطالعات با تنوع داده کمتر، بهعنوانمثال، SD کوچکتر یا CI باریکتر اغلب بهعنوان "کیفیت بهتر " در طراحی مطالعه در نظر گرفته میشوند. یک آمار وزنی که به دنبال ترکیب این دو عامل است که بهعنوان واریانس معکوس شناخته میشود، معمولاً استفاده میشود.
مرحله 5: برآورد نهایی اثر
مرحله نهایی انتخاب و اعمال یک مدل مناسب برای مقایسه اندازه اثر در مطالعات مختلف است. رایجترین مدلهای مورداستفاده، مدلهای جلوههای ثابت و جلوههای تصادفی هستند. مدلهای اثرات ثابت بر این فرض استوارند که هر مطالعه یک اثر درمانی مشترک را ارزیابی میکند. این به این معنی است که فرض بر این است که اگر سطوح مختلف تنوع نمونه در مطالعات مختلف نبود، همه مطالعات اندازه اثر یکسانی را تخمین میزنند. در مقابل، مدل اثرات تصادفی «فرض میکند که اثرات درمانی واقعی در مطالعات فردی ممکن است با یکدیگر متفاوت باشد». اینکه آیا این منبع دوم تنوع احتمالاً مهم است یا نه اغلب در فرا تحلیل با آزمایش «ناهمگونی» ارزیابی میشود.[3]
طرح جنگلی
تخمینهای نهایی از یک متاآنالیز اغلب بهصورت گرافیکی در قالب «طرح جنگل» گزارش میشوند.
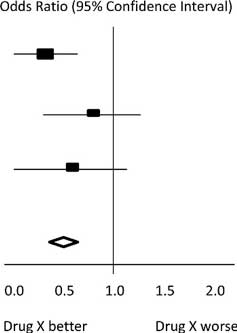
در نمودار فرضی Forest Plot نشان دادهشده در شکل زیر، برای هر مطالعه، یک خط افقی تخمین اندازه اثر استانداردشده (جعبه مستطیلی در مرکز هر خط) و 95٪CI برای نسبت ریسک استفادهشده را نشان میدهد. برای هر یک از مطالعات، داروی X خطر مرگ را کاهش داد (نسبت خطر کمتر از 1.0 است). بااینحال، مطالعه اول بزرگتر از دو مطالعه دیگر بود (اندازه جعبهها نشاندهنده وزن نسبی محاسبهشده توسط متاآنالیز است). شاید، به همین دلیل، تخمینها برای دو مطالعه کوچکتر ازنظر آماری معنیدار نبودند (خطوط برخاسته از جعبه آنها شامل مقدار 1 است). هنگامیکه هر سه مطالعه در متاآنالیز ترکیب شدند، همانطور که توسط الماسنشان داده شد، تخمین دقیقتری از اثر دارو به دست میآوریم، جایی که الماس هم تخمین نسبت ریسک ترکیبی و هم حدود 95٪CI را نشان میدهد. [7]
ارتباط با تمرین و تحقیق
بسیاری از تفسیرهای پرستاری مبتنی بر شواهد دارای ریویو سیستماتیک و متاآنالیز اخیراً منتشرشده هستند زیرا نهتنها بینش یا قدرت جدیدی را به توصیههایی در مورد مؤثرترین شیوههای مراقبت بهداشتی میآورند، بلکه همچنین مشخص میکنند که تحقیقات آینده باید به کجا انجام شود تا شکافها یا محدودیتهای موجود در شواهد فعلی را پر کند. قدرت نتیجهگیری از متاآنالیز تا حد زیادی به کیفیت دادههای موجود برای سنتز بستگی دارد. این نشاندهنده کیفیت مطالعات فردی و بررسی سیستماتیک است. متاآنالیز بهطور جادویی مشکل مطالعات ضعیف یا طراحی ضعیف را حل نمیکند و پزشکان میتوانند ناامید شوند و متوجه شوند که حتی زمانی که یک متاآنالیز انجامشده است، تنها چیزی که محققان میتوانند به این نتیجه برسند این است که شواهد ضعیف هستند و عدم اطمینان در مورد آن وجود دارد. اثرات درمان و اینکه برای اطلاعرسانی بهتر به تحقیقات با کیفیت بالاتر نیاز است. این هنوز یک یافته مهم است و میتواند عملکرد ما را آگاه کند و ما را به چالش بکشد تا شکافهای شواهد را با تحقیقات باکیفیت بهتر در آینده پر کنیم.[5]
خلاصه
متاآنالیز یک تحلیل آماری است که نتایج مطالعات علمی متعدد را ترکیب میکند. متاآنالیزها را میتوان زمانی انجام داد که مطالعات علمی متعددی وجود داشته باشد که به یک سؤال پاسخ میدهند و هر مطالعه جداگانه اندازهگیریهایی را گزارش میکند که انتظار میرود درجاتی از خطا داشته باشد. سپس هدف استفاده از رویکردهای آماری برای استخراج تخمین تلفیقی نزدیک به حقیقت رایج ناشناخته بر اساس نحوه درک این خطا است. نتایج متاآنالیز معتبرترین منبع شواهد در ادبیات پزشکی مبتنی بر شواهد در نظر گرفته میشوند.
متاآنالیز تخمین دقیقتری از اندازه اثر ارائه میدهد و قابلیت تعمیم نتایج مطالعات فردی را افزایش میدهد؛ بنابراین، ممکن است امکان حل تعارضات بین مطالعات را فراهم کند و زمانی که مطالعات فردی غیرقابل قطعیت هستند، نتایج قطعی به همراه داشته باشد. بااینحال، اخطارهای زیادی در کاربرد متاآنالیز وجود دارد. نتیجهگیریهای بهدستآمده از فرا تحلیل مستعد کیفیت روششناختی مطالعات گنجاندهشده و همچنین سوگیری انتشار و فرمولبندی معیارهای واجد شرایط بودن هستند. اگرچه ترکیب دادههای حاصل از مطالعات مستقل با استفاده از روشهای فرا تحلیلی میتواند دقت آماری را بهبود بخشد، اما نمیتواند بهطورکلی از سوگیری جلوگیری کند. بااینحال، بسیاری از انتقادات متاآنالیز برای ریویوهای روایی نیز صادق است. اگرچه فرا تحلیل به دلیل محدودیتهایش موردانتقاد قرار میگیرد، اما راهحلهایی برای این مشکلات وجود دارد. یک رویکرد سیستماتیک و شفافیت در انجام متاآنالیز به حل تعارضات و عدم قطعیتهای بین مطالعات و به دست آوردن نتیجهگیریهای معنادار کمک میکند. استفاده و ارزش متاآنالیز احتمالاً در آینده بر اساس قدرت آن در آشکارسازی یافتههای جدید افزایش مییابد.
منابع
[1] L. V Hedges, “Meta-analysis,” J. Educ. Stat., vol. 17, no. 4, pp. 279–296, 1992.
[2] I. K. Crombie and H. T. Davies, “What is meta-analysis,” What is, vol. 1, no. 8, 2009.
[3] A. P. Field and R. Gillett, “How to do a meta‐analysis,” Br. J. Math. Stat. Psychol., vol. 63, no. 3, pp. 665–694, 2010.
[4] R. Rosenthal and M. R. DiMatteo, “Meta-analysis: Recent developments in quantitative methods for literature reviews,” Annu. Rev. Psychol., vol. 52, no. 1, pp. 59–82, 2001.
[5] M. Borenstein, L. V Hedges, J. P. T. Higgins, and H. R. Rothstein, Introduction to meta-analysis. John Wiley & Sons, 2021.
[6] R. A. Guzzo, S. E. Jackson, and R. A. Katzell, “Meta-analysis analysis,” Res. Organ. Behav., vol. 9, no. 1, pp. 407–442, 1987.
[7] M. Egger, G. D. Smith, and A. N. Phillips, “Meta-analysis: principles and procedures,” Bmj, vol. 315, no. 7121, pp. 1533–1537, 1997.
[8] M. Egger and G. D. Smith, “Meta-analysis: potentials and promise,” Bmj, vol. 315, no. 7119, pp. 1371–1374, 1997.